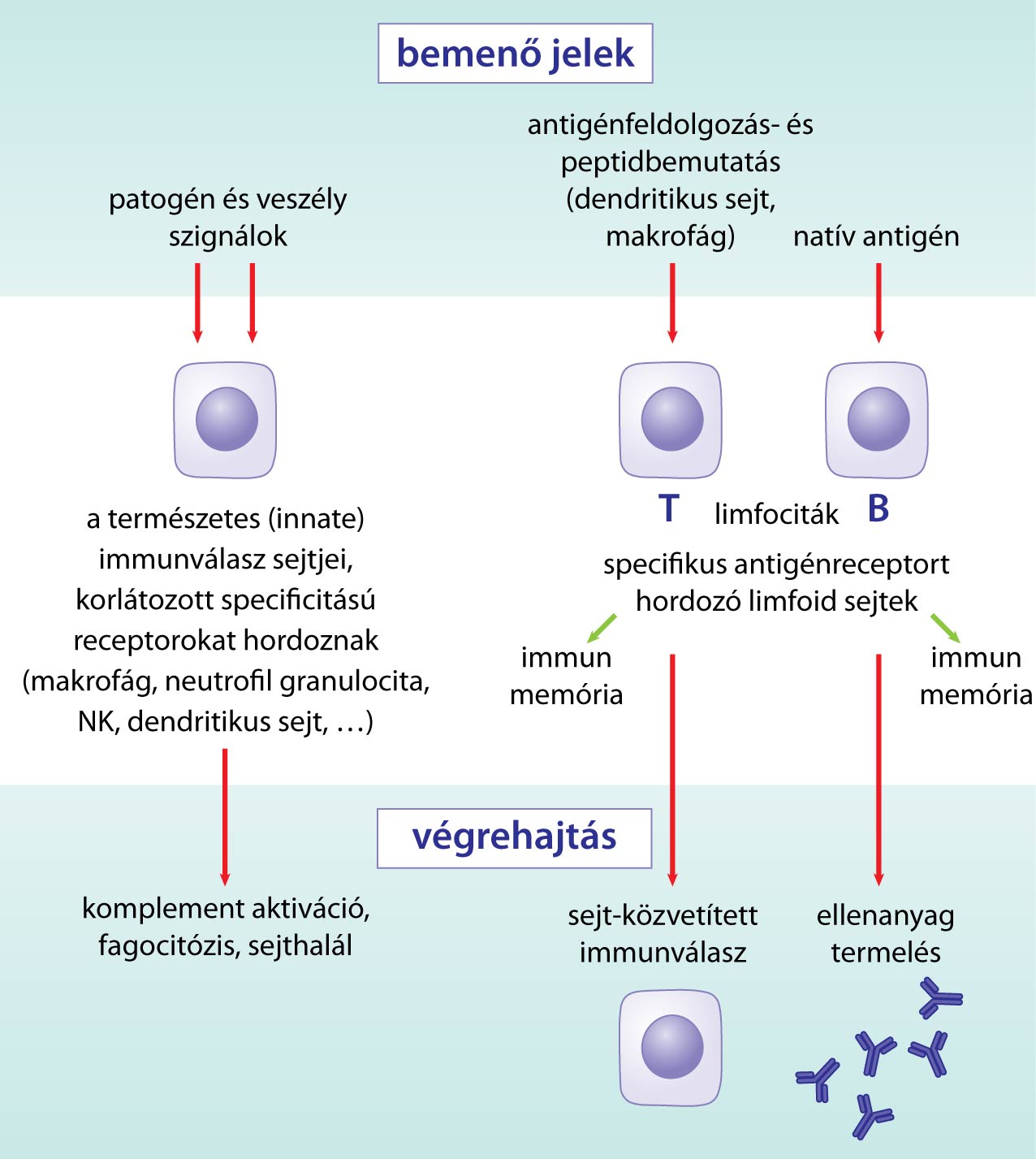
Az emberi szervezet létének fenntartásához alapvető fontosságú a belső környezet állandóságának biztosítása egy lényegesen eltérő, ráadásul sok esetben folyamatosan változó külső környezetben. Ez három feladat megoldását igényli: érzékelni kell a környezetet, az így nyert információt fel kell dolgozni, majd ez alapján megfelelő választ kell tudni adni. E részek teljesen nyilvánvalóak, ha az idegrendszerre gondolunk: mindenki számára világos, hogy mit értünk a környezet érzékelésén, ha mondjuk a szemre és a látásra gondolunk, világos az információfeldolgozás mibenléte, ha arra gondolunk, hogy az agy feldolgozza a vizuális információt és ez alapján dönt, és végül a válaszadás is értelemszerű, ha arra gondolunk, hogy megmozdítjuk a kezünket, melyet egy idegi utasítás vált ki. Sokkal kevésbé nyilvánvaló, de mára egyértelművé vált, hogy mindezek az immunrendszerről is elmondhatóak: bármilyen furcsa lehet első hallásra, de az immunrendszerünk is képes érzékelni a környezetet úgy, mint a szemünk (felismerés), képes feldolgozni ezt az információt úgy, mint az agyunk (jeltovábbítás, információfeldolgozás), és képes választ adni úgy, mint a karunk (végrehajtás, válaszadás). Sőt, van még egy, harmadik rendszerünk, melyről, ha kisebb specificitással is, de ugyanez elmondható: a hormonokat kiválasztó endokrin rendszer. Ma már ráadásul azt is tudjuk, hogy ezek közül egyiket sem lehet a többi közül kiragadni, ugyanis lépten-nyomon kölcsönható egységet alkotva gondoskodnak a belső egyensúly fenntartásáról, és így az egészség megőrzéséről. Hallatlanul izgalmas végiggondolni, hogy bár e rendszereink konkrét működése természetesen nagyon eltérő, de a mélyére ásva mégis csak azt látjuk, hogy valamennyi ezt a sémát követi.
Ha egymondatos definíciót kellene adni, hogy ezek közül pontosan mi az immunrendszer feladata, akkor úgy fogalmazhatnánk: a szervezettel kapcsolatba kerülő "veszélyes" és a "nem veszélyes" struktúrák – például szövetek, sejtek, fehérjék – felismerése, megkülönböztetése, majd ez alapján a megfelelő válasz adása. Ez a válasz lehet a nem-saját, veszélyes struktúra semlegesítése (elpusztítása, izolálása, a szervezetből való eltávolítása), a nem veszélyesként felismert struktúra esetén pedig annak elfogadása, megtűrése, a tolerancia. Sokan azt gondolják, hogy az immunrendszer a külső fertőzésekkel szemben véd minket, ám az előbbi definíció helytállóbb. Sőt, ma már tudjuk, hogy a lényeges választóvonal nem is a saját és a nem-saját között van, például ugyanúgy veszélyes struktúrát jelentenek a rosszindulatúvá vált saját-eredetű ráksejtek is, ezért fontos az immunrendszer szerepe a rosszindulatú tumorok elleni védekezésben is. Én most az immunrendszer működésének alapvonalait kívánom, nagyon leegyszerűsítve, bemutatni, hogy az alapvető szereplők, mechanizmusok, és logika világos legyen. A részleteket a szakirodalom bőségesen tárgyalja. Célom egyúttal, hogy bemutassam a hátterét a védőoltásokról általában szóló rész egyes pontjainak, mélyebben megmagyarázva azokat (így elsősorban a külső kórokozók elleni védekezésre fogok fókuszálni).
A fertőzésekkel szembeni első védvonalat az emberi szervezetben nem fajlagosan immunológiai megoldások szolgáltatják, hanem anatómiai gátak (barrierek), melyek fizikai vagy kémiai úton akadályozzák, hogy kórokozó egyáltalán a szervezetbe kerülhessen. A legkézenfekvőbb ilyen akadály a bőrünk, de ilyen szerepet tölt be a szem- és orrváladék, vagy épp a gyomorsav. Hasonló szerepet játszik a bőr, illetve a bélrendszer ún. normál baktériumflórája – a velünk együtt élő, nem kórokozó baktériumok részint csökkentik a kórokozók elszaporodásának a lehetőséget azáltal, hogy a rendelkezésre álló tápanyagokat, területet elfoglalják, részint gyakran kifejezetten a kórokozók szaporodását gátló anyagokat is kiválasztanak. (Ez az egyik oka, ami miatt a meggondolatlan antibiotikum-használat veszélyes lehet: e gyógyszerek ugyanis hatnak a normál baktériumflórára is.)
Amennyiben a kórokozó ezeken az akadályokon túljut, úgy már a "valódi" immunrendszer fog rá választ adni. Ahogy már volt róla szó, ennek az első lépése a felismerés. Mindazokat az anyagokat – legyenek azok molekulák, például fehérjék, szénhidrátok, vagy sejtek, egész mikrobák stb. – amiket az immunrendszer felismer, azaz rá reagál, antigénnek nevezzük.
A szervezetbe jutó antigének először általában az ún. veleszületett immunitással (vagy természetes, natív immunitás) kerülnek kapcsolatba. Ez immunrendszerünk ősibb ága (lényegében minden többsejtű élőlényben jelen van valamilyen formában), felismerési folyamata meglehetősen primitív, de cserében azonnal rendelkezésre áll, így gyors választ tud adni. A veleszületett immunitás olyan mintázatokat keres, melyek csak a kórokozókra jellemzőek, a szervezet saját struktúráira nem; ezeket szokás angol rövidítéssel PAMP-nak nevezni. Vegyünk egy konkrét példát: több kórokozó felszínén találhatóak olyan szénhidrát-alapú molekulák, melyek egy mannóz nevű cukorkomponenst tartalmaznak, ám az ember saját sejtjeiben ez nincs jelen – az ilyeneket keresik a mannózreceptorok. Szintén "gyanús" a flagellin nevű fehérje jelenléte, ez ugyanis az ostoros baktériumok ostorát alkotja; az ilyenekre a veleszületett immunrendszer TLR5 nevű receptorai vadásznak. A muramil-dipeptid nevű molekula több kórokozó baktérium sejtfalának az alkotója, ezt a NOD2 nevű receptor keresi; és így tovább, és így tovább. Ezek a veleszületett immunitás sejthez kötött elemei: mindig valamilyen sejt felszínen (ilyenek a TLR-receptorok), vagy annak belsejében (ilyenek a NOD-receptorok) találhatóak, a szokásos elnevezésük mintázatfelismerő receptor, angol rövidítéssel PRR. A mintázatfelismerő receptorokat a veleszületett immunrendszer sejtjei hordozzák, melyek testünk számos pontján megtalálhatóak, de különösen ott, ahol a kórokozók bejutása a legvalószínűbb (bőr, gyomor-bél traktus, orrgarat stb.); éppen emiatt ezeket szokták "őrszem" (sentinel) sejteknek is nevezni. Ilyen sejtek a makrofágok, melyek a fehérvérsejtjeink monocitának nevezett típusából alakulnak ki, a dendritikus sejtek és az epitélsejtek. A veleszületett immunrendszernek vannak nem adott sejthez kötött, hanem oldékony komponensei is; ilyen például a C-reaktív protein (CRP), mely – többek között – a foszfokolin nevű molekulát ismeri fel, amely gyakran jelenik meg sérült sejtek felszínén, és megtalálható bizonyos kórokozók, például a pneumococcus baktérium sejtfalában is. Oldékony komponensről van szó: a CRP nem egy adott sejthez van kötve, mint a TLR- vagy NOD-receptorok, hanem a vérünkben kering, "vadászva" az általa felismert mintázatokra. Végezetül ide tartozik az ún. komplementrendszer is, erről azonban kicsit később szeretnék szót ejteni. Összességében elmondható, hogy a veleszületett immunrendszer receptorai mindössze néhány tucat típusból kerülnek ki.
Látható, hogy a felismerési folyamat a veleszületett immunválaszban nem specifikus, a szónak olyan értelmében, hogy nem adott, konkrét kórokozót keres, hanem általában kórokozóra gyanús mintázatokat. Másrészről ezek a receptorok, illetve funkciók a kórokozókkal való találkozástól teljesen függetlenül, eleve jelen vannak az emberi szervezetben – jogos tehát a "veleszületett" szó használata –, ez lehetővé teszi a gyors válaszadást. Cserében, mivel ezek a funkciók genetikailag – a csíravonalban – kódoltak, és így nem változnak a kórokozóval való találkozással, ez a rendszer nem tud tanulni, azaz nem tud változni, adaptálódni a korábbi válaszadások fényében (nincsen memóriája, mely ehhez szükséges lenne). Veleszületett immunitás szempontjából minden egyed mindig ugyanúgy néz ki (például az emberi mintázatfelismerő receptorok mindenkiben pontosan ugyanazok), és idővel sem változnak, azaz mindig pontosan ugyanazt a reakciót adja az adott antigénre, függetlenül attól, hogy találkozott-e már vele az ember – de cserében ez a reakció azonnal rendelkezésre áll.
Ha megtörtént a felismerés, akkor következik az immunválasz második lépése, a jelfeldolgozás, ill. jeltovábbítás fázisa. Ez a veleszületett immunválasz esetében többféle folyamaton keresztül is megvalósul. Egyrészt a sentinel sejtek felismerés esetén olyan anyagokat bocsátanak ki, amelyek odacsalogatják a válaszadó (azaz a felismert idegen sejtet vagy anyagot elpusztító) elemeit az immunrendszernek. Ezek egyfajta hírvivők: az idegent felismerő "őrszemek" ezek révén közlik, hogy "katonákra" van szükségük. (A dolog kicsit a hormonokhoz hasonlít: azokat is arra használja a szervezet, hogy információt jutasson el annak keletkezési helyétől kisebb-nagyobb távolságra.) A legfontosabb ilyen jelzőmolekulák az ún. citokinek. (Ez nem egy konkrét molekulát jelent, hanem egy hatalmas családot, sőt, családok összességét, melyek számtalan egyéb funkciót is ellátnak.) A másik alapvető út az ún. komplementrendszer. Ez egy számos, egymásra épülő komponensből álló rendszer, melynek legfőbb jellemzője a láncreakció-szerű viselkedés: ha az első komponens aktiválódik, akkor az aktiválja a másodikat, ami a harmadikat és így tovább. (Úgy is szokták mondani: kaszkádot alkotnak.) A rendszer több – három – úton is beindítható (ez a felismerés szakasza), de a végső lefutása mindig ugyanaz lesz, mely megvalósítja az információtovábbítást, hiszen a válaszadást fogja – többek között – támogatni. A kaszkád lefutását számos elem szabályozza, illetve önmagára visszaható lépéseket, visszacsatolásokat is tartalmaz.
Ha megtörtént a felismerés és a szükséges információtovábbítás és -feldolgozás is, akkor már csak egyetlen lépés van hátra, a harmadik: a válaszadás. Ezt szokták más szóval effektor funkciónak is nevezni (kifejti a hatást, azaz effektust). Ennek módszereit érdemes kettéválasztani: amennyiben a veszélyes struktúra leküzdése élő sejt által történik, akkor celluláris (sejt-közvetített) válaszról beszélünk, amennyiben élettelen molekulával, akkor humorális (oldékony) válaszról.
A veleszületett immunitás legfontosabb celluláris immunválasza a fagocitózis. Ez azt jelenti, hogy a leküzdendő sejtet vagy molekulát az immunrendszer sejtje körbeöleli, bekebelezi, majd miután az a sejten belülre került, különféle enzimekkel és nagyon hatékony oxigén gyökökkel szétbontja, így megsemmisítve azt, a lebontott maradványokat pedig kibocsátja a sejtből. Az immunrendszer egyes sejtjeinek kifejezett feladatuk a fagocitózis végrehajtása, ezeket szokás fagocitáknak vagy falósejtnek nevezni. Egyik legfontosabb típusukat a makrofágok jelentik: ezek a fehérvérsejtjeink monocita nevű típusából képződnek a szervezet különböző részeiben, jórészt miután kiléptek a vérkeringésből. Megtalálhatóak a tüdőben (alveoláris makrofágok), a bélcsatornában, a májban (Kupffer-sejtek), az agyban (mikroglia), a vesében (mezangiális makrofágok) és így tovább. Fontos további fagocita a fehérvérsejtek neutrofil granulocita nevű típusa, és a dendritikus sejtek; de számos egyéb sejt is képes "mellékállásban" fagocitózisra. Azt, hogy a fagociták oda találjanak ahol szükség van rájuk, tehát ahol leküzdendő struktúra jelent meg, épp az előbbi pontban leírt jeltovábbítási mechanizmusok irányítják (többek között tehát a küzdelmet már felvett fagociták által kibocsátott anyagok). A másik alapvető ágát a veleszületett immunitás celluláris válaszának az ún. természetes ölő (NK) sejtek jelentik. Ezek a fehérvérsejtek limfocitának nevezett típusaival rokonok, és két szempontból is eltérnek működésüket tekintve az előbbiektől. Egyrészt nem közvetlenül az idegen struktúrát pusztítják el, hanem a szervezet saját, veszélyessé vált sejtjeit, ezért elsősorban a vírusok elleni védekezésben van szerepük (a vírusok a megtámadott szervezet saját sejtjeit fertőzik meg, és veszik át fölöttük az irányítást), valamint a daganatsejtek elleni küzdelemben. A másik különlegességük, hogy trükkös szabályozómechanizmusok révén nem csak valamilyen gyanús mintázat jelenlétére érzékenyek, hanem valamilyen elvárt mintázat hiányára is, ami ismét csak az előbbi célok elérését segíti (mert a tumoros, vagy vírussal fertőzött sejtekből gyakran hiányoznak bizonyos, egészséges sejtekben jelenlévő molekuláris struktúrák). Az elpusztítás mechanizmusa eltér a fagocitákétól: az NK sejtek nem bekebelezik a célpontot, hanem sejtméregként viselkedő fehérjéket bocsátanak ki rá (citotoxikus hatás), illetve a fagocitákhoz hasonlóan ők is részt vesznek jeltovábbító funkcióban is: megjelölik a célpontot további immunválaszra.
A veleszületett immunitás humorális immunválasza antimikrobiális peptidekből (pl. defenzin) és fehérjebontó enzimekből áll, illetve idetartozik az ún. membránkárosító komplex (MAC), mely a komplementrendszer aktiválódásának révén jön létre, és szintén – nem élő, nem sejtes rendszerként – képes leküzdeni az idegenként megjelölt célpontot.
A veleszületett immunrendszer válaszadási folyamatának klinikai megjelenése nem más, mint a jól ismert gyulladás; persze ebben, komplex folyamatról lévén szó, számos egyéb tényező is szerepet játszik. (A genny például jórészt elhalt neutrofil granulocitákból áll.)
Mindezeket összefoglalva: a veleszületett immunitás nem tud nagyon nagy erejű választ adni, abból is adódóan, hogy nem képes tanulni, ám cserében a reakciója rendkívül gyors.
Mintegy 400 millió évvel ezelőtt azonban megjelent egy új, egészen másfajta immunitás a törzsfejlődés során, először a porcos halakban. Egy olyan rendszer, mely csak jóval lassabban reagál, de cserében nagyobb hatásossággal, mert a válasz az idegenként felismert struktúrára "testreszabott" (specifikus). Sőt, a válaszadásból a rendszer képes tanulni, mert "emlékszik" a legutóbbi válaszadásra, így a későbbiekben még hatásosabb tud lenni. Ezt a rendszer hívjuk adaptív immunitásnak (vagy szerzett immunitás).
A korábbi felfogás úgy tartotta, hogy a veleszületett és a szerzett immunitás két elkülönülő rendszer, melyből a veleszületett a "primitívebb", az egyszerűbb esetek gyors kezelésére, míg a szerzett immunválasz a kifinomultabb, minden más helyzetre. Ma már tudjuk, hogy ez nem igaz: egyrészt a kétféle immunválasz nem válik el élesen egymástól a szervezetünkben, épp ellenkezőleg, lépten-nyomon átlapolódó, összefüggő rendszert alkotnak, másrészt a veleszületett immunitás nem csak "nem túl jó, de legalább valamilyen" jellegű gyorssegély a kezdeti időkre, ami aztán eltűnik és átadja a helyét, hanem alapvető szerepet játszik a későbbi adaptív válasz irányának meghatározásában is.
Tekintsük át az adaptív immunitást is a korábban már látott hármas tagolásnak megfelelően – hiszen természetesen itt is élni fog ez a hármasság.
Az első lépés a felismerés. Az adaptív immunitás esetében két sejttípus végzi a felismerést: a B és a T limfocita; mindkettő a fehérvérsejtjeink limfocitának nevezett típusának az altípusa. A felismerés szempontjából a kettő között lényeges különbség van: a B limfocita magát az antigént ismeri fel közvetlenül, nem szükséges hozzá annak semmilyen átalakítása (úgy is szokták mondani: natív, nem feldolgozott antigént ismer fel), addig a T limfocita erre nem képes. Ahhoz, hogy a T limfocita felismerjen egy antigént egyfajta "előfeldolgozás" szükséges: más sejteknek kell átalakítani az antigént, olyan formára hozva, amit már a T limfocita is fel tud ismerni. Ezt a folyamatot hívjuk antigénprezentációnak. Sokféle sejt képes erre, ám vannak, amelyeknek ez a kifejezett "szakterületük", ezeket nevezzük hivatásos antigénprezentáló sejteknek (általánosan használt angol rövidítéssel: APC); ilyenek a dendritikus sejtek, a makrofágok, de a B limfociták maguk is képesek erre (amellett, hogy felismeri is tudnak).
És itt rögtön belefutunk egy nagyon szép példájába a kétféle immunitás összefüggésének, hiszen láthatjuk, hogy a listán szerepelnek ugyanazok a makrofágok, amikkel a veleszületett immunitás kapcsán is többször találkoztunk. Valóban, kicsit csaltam, amikor azt mondtam, hogy a makrofágok fagocita-funkciója kimerül abban, hogy a bekebelezett struktúrát teljesen lebontják. A valóságban mást is tesznek: bekebelezik a sejtet, de teljes lebontás mellett azt az átalakítást is elvégzik, amire a T sejteknek szükségük van a felismeréshez. Ez pedig nem más, mint az idegen struktúra részbeni lebontása, majd hozzákapcsolása egy MHC-nak (fő hisztokompatibilitási komplex) nevezett fehérjéhez. Az MHC molekulákat szüleinktől örököljük, sejtjeinken az apai és az anyai MHC is kifejeződik. A makrofágok, illetve általában az APC-k elvégzik ezeket a lépéseket, majd a végeredményt, az átalakított és MHC-hez kötött antigént megjelenítik a saját felszínükön – ahol a T sejtek már rájuk tudnak találni, és fel tudják ismerni az antigént.
T sejt felismerni tehát csak MHC-hez kötött antigént tud, fontos azonban megjegyezni, hogy kétféle MHC-fehérje létezik. Az MHC-I-hez a prezentáló sejten belül képződött antigének, például tumor- vagy vírusantigének kötődnek, az ilyeneket a T limfociták CD8+ T limfocita nevű fajtája ismeri fel; az MHC-II-höz a prezentáló sejten kívül képződött (és aztán fagocitált) antigének, például baktériumantigének kötődnek, az ilyeneket a T limfociták CD4+ nevű fajtája ismeri fel. MHC-I-et szervezetünk minden sejtmaggal rendelkező sejtje ki tud fejezni, tehát prezentálhat antigént, MHC-II-t alapvetően csak a hivatásos APC-k.
A felismerés maga azonban drámaian eltér a veleszületett immunitásétól. Természetesen a konkrét mechanizmusában is, hiszen az teljesen más, de ami még fontosabb, hogy jellegében is: az adaptív immunitás felismerése specifikus – nem általában keres kórokozót, mint a veleszületett immunitás, hanem konkrét kórokozót keres. Ami a veleszületett immunitás számára "egy baktérium", az a szerzett immunitásnak "O157:H7 szerotípusú Escherichia nemzetségbe tartozó E. coli baktérium".
Hogyan lehetséges ez? A B és T sejtek felszínén egyaránt találhatóak receptorok az antigén felismerésére, ezeket hívjuk B sejt receptornak (BCR) és T sejt receptornak (TCR). Ebből a szempontból nincs különbség veleszületett és szerzett immunitás között: itt is és ott is receptorok vannak az antigének felismerésére, és itt is és ott is szám szerint rengeteg van belőlük. Csakhogy, míg a veleszületett immunitás receptorai mindössze néhány tucat különböző típusból kerülnek ki, addig a szerzett immunitás receptorai akár több száz milliárd különböző receptort jelentenek, azaz ennyiféle különböző antigént tudnak konkrétan, célirányosan felismerni (minden receptor egyféle antigént).
Így már érthető, hogy a szerzett immunitás miért tud ennyire specifikus lenni, de vajon hogyan tud létrejönni ekkora változatosság? A különbség oka az, hogy míg a veleszületett immunitás receptorai csíravonalban kódoltak ("eleve velünk jönnek"), addig a szerzett immunitás receptorai életünk során ("menet közben") is alakulnak. Az érdekes az, hogy nem arról van szó, hogy célirányosan létrehoz ennyiféle specificitású receptort a szervezetünk, hanem valójában még ennél is többet hoz létre, lényegében vaktában... csakhogy aztán "kiválogatja" azokat, amikre várhatóan szükség van. Hogy ez ilyen formában működjön, ahhoz két dolog szükséges: 1) a potenciál, hogy a receptorok elképesztően sokfélék tudjanak lenni, annak ellenére is, hogy a mögöttük lévő genetikai háttér egységes, és közel nem tud ennyi variációt lehetővé tenni 2) valamilyen mechanizmus, mely ténylegesen ki is alakítja a szükséges változatosságot, azaz elvégzi ezt a válogatást. Az előbbit számos tényező teszi lehetővé, közülük is az egyik legfontosabb az ún. V(D)J rekombináció, vagy más szóval szomatikus rekombináció (génátrendeződés). Nagyon leegyszerűsítve arról van szó, hogy a receptorokat kódoló gének nem rögzített módon fejeződnek ki, hanem az egyes szakaszaik – ezeket jelölik a V, D, J és egyéb betűk – meglehetősen szabadon variálódhatnak a T és B sejtek egyedfejlődése során, így a kisszámú építőelemből is hihetetlen nagy számú kombináció alakulhat ki. Ami a második kérdést illeti, ismét csak nagyon leegyszerűsítve arról van szó, hogy a limfociták az érési folyamatuk során ún. szelekciós lépéseken esnek át. A negatív szelekció során elpusztulnak vagy átalakulnak azok a limfociták, amelyek túlságosan erősen reagálnak a szervezet antigénjeivel, hiszen félő, hogy az ilyenek nem tolerálnák a sajátot sem. Ez a negatív szelekció az egyik alapvető oka annak (az ún. centrális tolerancia), hogy az immunrendszerünk miért nem reagál a szervezet saját alkotóira – azaz az egyik fő védelmi mechanizmus az autoimmunitással szemben. A T sejtek ezen kívül átesnek egy pozitív szelekción is, egyébként még a negatív szelekciót megelőzően, ami biztosítja, hogy csak olyan T sejt érjen meg, ami saját MHC-val viszont képes kapcsolódni. Végeredményben azt látjuk, hogy a B és T sejtek képesek a megfelelő antigéneket – és csak azokat – felismerni, de hogy hogyan alakul ki olyan B és T sejt populáció egy emberben, ami tényleg a célszerű antigéneket ismeri fel, azaz azokat, amikkel az alany a valóságban találkozhat, az ebből még nem világos. Ennek megértéséhez meg kell ismernünk a szerzett immunitás egy olyan tulajdonságát, ami a veleszületett immunitásban nincsen jelen, ez lesz a tanulás, de erről majd picit később.
Nagyon érdekes a második lépés, az információfeldolgozás fázisa a szerzett immunitásban. Ennek megértéséhez térjünk oda vissza, hogy megtörtént a felismerés, a B vagy T sejt kapcsolódott a – neki megfelelő – antigénnel. A felismerés, a kötődés – akár T, akár B limfocitáról van szó – megfelelő körülmények között az ún. limfocita-aktivációt váltja ki, ami az adott antigénre specifikus limfocita gyors osztódásához vezet; ezt hívjuk klonális expanziónak. (A klonális szó arra utal, hogy valamennyi ilyen módon létrejövő sejt pontosan az eredetivel megegyező antigéneket ismeri fel.)
Naiv (antigénnel korábban még nem találkozott) T limfociták esetén az aktiválódáshoz kevés önmagában az antigénnel való kötődés. A "megfelelő körülmények" azt jelenti, hogy szükség van egy ún. második jelre, egy veleszületett immunrendszertől, illetve antigénprezentáló sejttől származó szignálra – egy molekulára, melyet a T sejtet felszínén egy receptor felismer – enélkül hiába kötődik a TCR az antigén+MHC-hoz, nem fog létrejönni az aktiválódás. Ezt szokás kostimulációnak is nevezni; ez a mechanizmus ismét csak az autoimmunitás ellen véd, hiszen "dupla biztonságot" adva véd a téves aktiválódás ellen. Ez a perifériás tolerancia része (azért perifériás, mert a már érett, az érési centrumból kikerült limfocitákra vonatkozik). A második jel hiánya nem egyszerűen nem segíti a T limfocita aktiválódását, hanem kifejezetten megakadályozza azt.
A CD4+ T sejtekben e két jel alapján megtörténik az aktiváció, azaz olyan sejten belüli folyamatok indulnak be, melyek ahhoz vezetnek, hogy a T sejt nagyon gyorsan osztódni kezd. A CD4+ sejtekkel azonban az osztódáson kívül más is történik: differenciálódnak, azaz különböző jellegű sejtekké alakulnak. Egy részük segítő (helper) T limfocitává (rövidítésük: Th) alakul, melyeknek három fő csoportja van: a Th1, a Th2 és a Th17. E limfociták a nevüket onnan kapták, hogy saját maguk nem vesznek részt a válaszadásban, csak irányítják más sejtek – az effektorok – válaszadását. A részleteket később, az effektor funkciók leírásánál fogjuk látni, de a lényeg, hogy a Th1 limfociták azt a fajta effektor választ segítik, mely a sejten belüli, intracelluláris kórokozók ellen hatásos (pl. vírusok), míg a Th2 limfociták a sejten kívüli, extracelluláris kórokozók (pl. férgek) és az allergiás reakciót kiváltó antigének elleni választ támogatják. (A Th17 szintén bizonyos sejten kívüli kórokozók, meghatározott baktériumok és gombák elleni választ irányít.) Nagyon érdekes kérdés, hogy mi dönti el, hogy a differenciálódás melyik irányba megy el – és itt eljutunk ahhoz a kérdéshez, hogy a veleszületett immunitásnak miért van alapvető szerepe az adaptív immunitásban is. A helyzet ugyanis az, hogy ezt a kérdést, bár sok tényezője van, de elsősorban az határozza meg, hogy az aktiválódás helyén milyen citokinek (mint hírvivő molekulák) vannak jelen – melyet elsősorban a veleszületett immunitás sejtjei termelnek. Ha egy IL-12 nevű citokin van jelen, akkor a differenciálódás Th1 irányba megy el, márpedig ezt a citokint – figyeljük meg, milyen szépen összeérnek a történet szálai! – akkor választják ki a veleszületett immunitás sejtjei, elsősorban a dendritikus sejtek és az NK sejtek, ha intracelluláris kórokozóval kell megküzdeniük. A Th2 irányú differenciálódást elsősorban az IL-4 nevű citokin serkenti, ezt pedig akkor termelik a veleszületett immunitás sejtjei, ha extracelluláris kórokozóra kell választ adni. Ezt a jelenséget szokás néha "harmadik jel"-nek is nevezni. Azt is fontos megjegyezni, hogy az egyes típusok gátolják a többi létrejöttét, ami ahhoz vezet, hogy – különösen a veszélyesebb kórokozók esetén – az immunrendszer adott szakaszában inkább vagy csak az egyik, vagy csak a másik van jelen, de nem a kettő keverten. Ezt szokás az immunrendszer Th1/Th2 polarizációjának is nevezni.
Hogyan valósul meg a Th sejtek válaszadást irányító funkciója? Úgy, hogy a megfelelő citokineket bocsátják ki, ezzel, mint információküldő "képességgel" tudják a karmesteri funkciójukat betölteni. A Th1 sejtek IFN-\(\gamma\)-t (interferon-\(\gamma\)-t) és IL-2-t bocsátanak ki, ezek a már látott sejtek közül a makrofágokat és az NK sejteket aktiválják, valamint a szerzett immunitás (hamarosan bemutatandó) celluláris válaszának sejtjeit – valamennyi csakugyan az intracelluláris kórokozók ellen hat, azáltal, hogy a megfertőzött sejtet elpusztítják. A Th2 sejtek IL-4, IL-5-öt és IL-13-at választanak ki (azaz saját maguk "utánpótlását" is serkentik), mely egyrészt a B sejt választ irányítja, másrészt a fehérvérsejtjeink eozinofil granulocitának nevezett típusának aktiválást is elvégzik – mindkettő valóban az extracelluláris kórokozók ellen fog hatni.
A CD4+ T sejtekből még egy csoport tud differenciálódni: a szabályozó (regulátor) T limfociták (rövidítésük: Treg), melyeknek szerepe elsősorban az elindult limfocita expanzió megállításában van; de egyéb immunsejtek aktivációját is gátolják azáltal, hogy ilyenre utasító citokineket bocsátanak ki. Ilyen módon a Treg sejtek működése szintén a perifériás tolerancia része.
A CD8+ T sejtek aktiválódás esetén ún. citotoxikus T limfocitává (rövidítésük: Tc) válnak. Ez megtörténhet közvetlenül, tehát a CD8+ T sejt receptorának és az antigén+MHC-nek a kötődésével (a második jelre, a kostimulációra itt is ugyanúgy szükség van!), de egyes esetekben CD4+ T sejt is szükséges az aktiválódáshoz. Akárhogy is, ha megtörtént az aktiváció, akkor ugyanúgy klonális expanzió következik, ám az így létrejött Tc sejtek már közvetlen effektor funkcióval bírnak, melyet mindjárt látni is fogunk.
Végezetül nem beszéltünk még a B sejtekről. Ezek aktiválódása kapcsán meg kell különböztetnünk az ún. T-dependens és a T-independens antigéneket. Az előbbiek azokat az antigéneket jelölik, melyek révén a B sejt tud kapcsolódni majd aktiválódni – de csak akkor, ha T sejt is jelen van. Ebben az esetben a B sejt lényegében antigénprezentáló sejtként viselkedik a T sejt számára. A T-independens esetben a B sejt receptor és az antigén közti kapcsolódás T sejt segítsége nélkül is létre tud jönni. Példának okáért, a T sejtek csak fehérje-jellegű antigének tudnak felismerni, ám a B sejtek ennél többet, például poliszacharidot is. Ennek megfelelően a poliszacharidok automatikusan T-independens antigénnek minősülnek. Amennyiben a B sejtek aktiválódnak, ugyanolyan klonális expanzió következik be, mint a T sejteknél, ez teszi majd lehetővé a későbbi effektor funkció betöltését.
Térjünk is akkor át a válaszadó (effektor) funkcióra! A szerzett immunitás effektor funkciójának a veleszületett immunitáshoz hasonlóan két ága van. Mindkét ágra egységesen jellemző, ezt az előbbiekben láttuk is, hogy a beindulásukat megelőző információfeldolgozáshoz, azaz a működésükhöz sejtek osztódására van szükség (szemben a veleszületett immunitással), ami persze időt vesz igénybe – ez a magyarázata annak, hogy a szerzett immunitás miért reagál lassabban, szemben a veleszületett immunitással, ami azonnal rendelkezésre áll. De ugyanez egyúttal az eltérő erejükkel is összefügg: a veleszületett immunitás válasza csak korlátozottan képes "fokozódni", míg a szerzett immunitás, a sejtosztódás kihasználásának köszönhetően idővel sokkal hatékonyabbá is tud erősödni, gyorsan szaporodó kórokozókkal is felvéve a versenyfutást.
A két ág tehát itt is a humorális és a celluláris. A celluláris válasz effektorai a szerzett immunitásban pedig nem mások, mint a Tc limfociták. Ahogy volt róla szó, ezeket elsősorban sejten belüli nem-saját ellen veti be a szervezet, például vírussal fertőzött, vagy tumoros sejtek ellen. Ez megtörténhet olyan módon, hogy a sejt maga jelzi az MHC-I-gyel együtt megjelenő antigénpeptiddel a "problémát" (erre minden sejtünk képes, hiszen minden magvas sejtünk rendelkezik MHC-I-gyel), és a CD8+ T limfocita közvetlenül rákapcsolódik a bemutatott antigénre, vagy pedig úgy, hogy APC mutatja be a feldolgozott kórokozót az MHC-II-jén, de olyan jelek mellett, melyek a Th1 választ indítják el. Korábban szerepelt, hogy ez többek között a "szerzett immunitás celluláris válaszának sejtjeit" aktiválja – most már elárulhatom, hogy ezek természetesen nem mások, mint a Tc limfociták. A leküzdés módja ez esetben a teljes sejt elpusztítása; erre a Tc limfocitáknak több eszközük is van, de végeredményben mindegyikkel azt érik el, hogy a célsejtben beinduljon a programozott sejthalál, az apoptózis. (Például olyan anyagot bocsátanak ki, melyek megnövelik a célsejt falának áteresztőképességét, majd olyat, ami az így kialakult póruson bejutva kiváltja az apoptózist.)
A humorális válasz effektorai az ún. antitestek (ellenanyagok), vagy más szóval immunglobulinok. Ezeket az oldható fehérjemolekulákat a B sejtek termelik, a fent említett expanzió után. Kicsit részletesebben elmondva arról van szó, hogy a B sejtek az aktiválódást követően nem csak felszaporodnak, hanem minőségi változáson is átmennek: úgynevezett plazmasejtté differenciálódnak. A plazmasejteknek pedig egyetlen feladatuk van: elkezdenek ellenanyagot termelni. Az egy B sejtből leszármazott plazmasejtek mind ugyanazt az ellenanyagot termelik, és ez pedig nem más, mint az az ellenanyag, ami a B sejt által felismert antigénhez tud kötődni.
Arról van ugyanis szó, hogy az antitestek specifikusan tudnak kötődni egy antigénhez, márpedig ha ez megtörténik, akkor beindul az effektor funkció. Sok esetben az antitest bekötése önmagában gátolja a célsejt funkcióját, például mozgásképtelenné teszi azt, vagy blokkolja az aktív területét (neutralizáció). Másrészt az antitest rákötése megjelöli a sejtet a veleszületett immunitás számára, és beindítja a komplementrendszert, valamint segíti a fagocitózist.
Az antitesteknek többféle változata, ún. izotípusa van, melyek eltérnek pontos biológiai funkciójukban, képességeikben. A legnagyobb csoportot az IgG osztályú antitestek jelentik, melyek nagy sokoldalúak effektor funkciójukat tekintve. Ez az egyetlen osztály, mely át tud jutni a méhlepényen, így létrehozva a maternális immunitást: ez az a jelenség, hogy az anya vérében keringő – IgG osztályú – antitestek a születendő csecsemőbe átjutva számára is átmeneti védelmet adnak (azon kórokozók ellen, melyre nézve az anyának IgG antitestje van). Az emberi emésztőrendszer – szemben egyes állatokkal – nem képes IgG osztályú antitestet felvenni (az anyatejbe ezért érdemi mértékben ki sem választódik), így ez a védelem a méhen belüli fejlődés alatt jön létre, később, az anyatejjel már nem átvihető. Az IgM osztályú antitestek nagyrészt a vérben találhatóak meg, és elsősorban a komplement-rendszer aktiválása az erősségük. Az IgA osztályú antitestek egy része a különféle nyálkahártyák – légzőrendszer, gyomor-béltraktus stb. – felszínére választódik ki (szekretoros IgA), így azokat védi. IgA osztályú antitestek kiválasztódnak az anyatejbe is, így védelmet tudnak adni az anyatejes táplálás révén a csecsemőnek (elsősorban értelemszerűen a gyomor-bélrendszerben, de kisebb mértékben a légzőrendszerben is, amennyire némi anyatej oda is jut a táplálkozás során). Az IgD nagyon kis mennyiségben előforduló típus, jelentőségéről keveset tudunk. Végezetül az IgE izotípusú antitestek a paraziták elleni védelemben, és az allergiás reakciókban játszanak szerepet. (Hozzákötődnek az ún. hízósejtekhez, melyek ennek hatására degranulálódnak, és az így felszabaduló anyagok közvetítik az allergiás reakciót.)
Az összes felsorolt folyamatot mutatja összefoglalóan a következő ábra.
Egy kérdés maradt nyitva még: mi a "karmester", jelen esetben a Th2 limfociták szerepe a B sejtes, humorális válaszban? A T-independens antigének esetén semmi, ilyenkor az aktiváció és expanzió e nélkül lezajlik, mégpedig gyorsan, és jórészt IgM osztályú antitesteket fognak termelni az így létrejövő plazmasejtek. Érdekesebb a helyzet a T-dependens antigéneknél. Itt a Th2 limfociták egyik szerepe, hogy serkentik a B limfociták aktiválódását. A másik szerep megértéséhez tudni kell, hogy kezdetben csak IgM (és némi IgD) osztályú ellenanyagot termelnek a B sejtek – a Th2 limfociták második funkciója, hogy létrehozzák az ún. osztályváltást, azaz elérik, hogy a B sejtek végül is egyéb izotípusú antitesteket is termeljenek.
Végezetül egy nagyon fontos kérdést kell még megbeszélni, mely az egész szerzett immunitás egyik legalapvetőbb jellemzője. Ez pedig az a képessége, hogy – szemben a veleszületett immunitással – tanuljon a korábbi találkozásokból. Tehát bár az első találkozásnál nem fog hatékony választ adni, de másodszor, harmadszor stb. már egyre inkább, mert emlékezni fog a korábbi találkozásokra, és ezt fel tudja használni. (A veleszületett immunrendszer, mint láttuk, nem ilyen – de cserében a kevésbé hatékony válasza nagyon gyors tud lenni, bármelyik találkozáskor.) Ezt hívják immunológiai memóriának, folyamatait összefoglalóan mutatja a következő ábra:
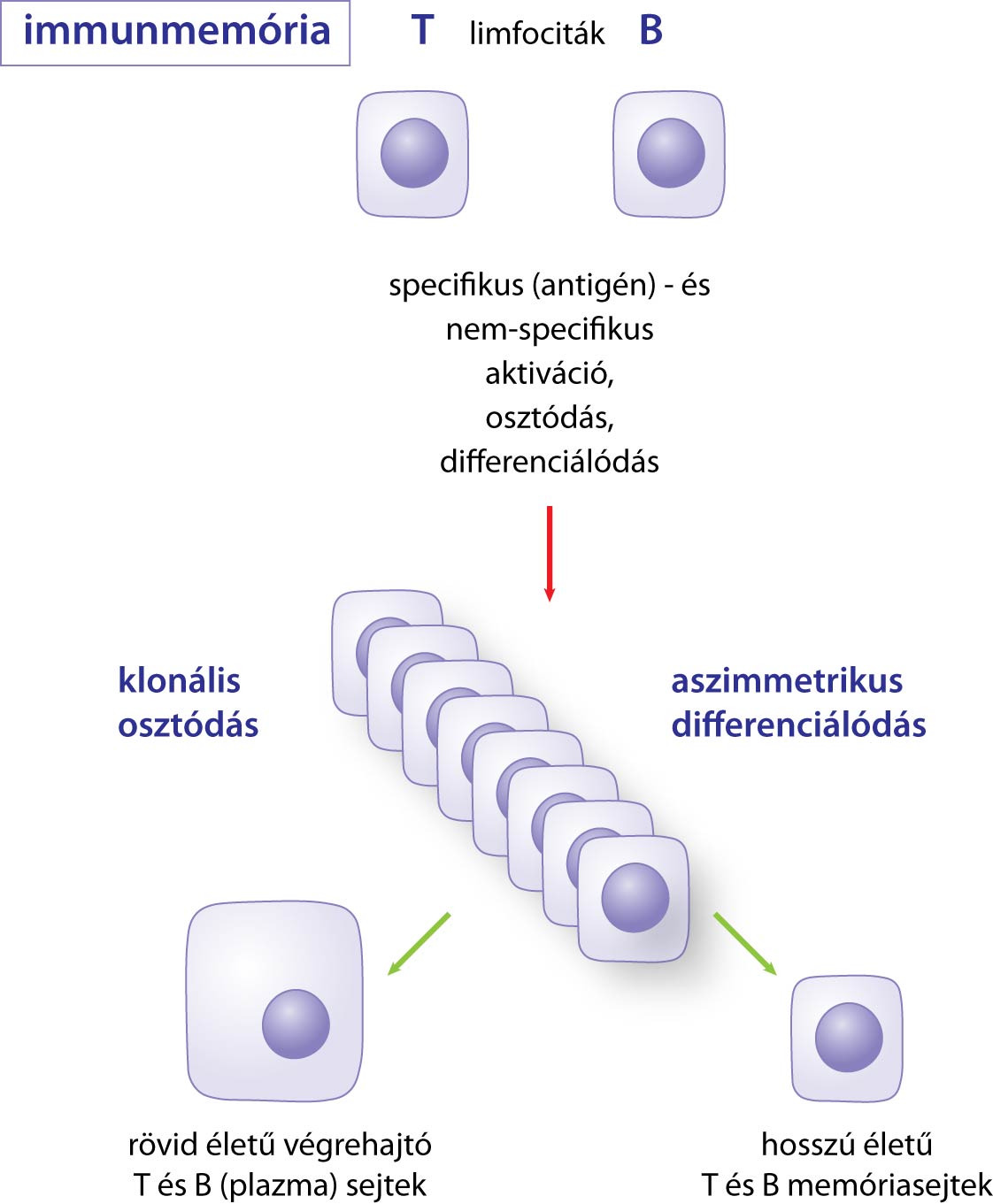
A működésének az alapja, hogy a limfociták expanziója után a szervezet nem számolja fel az összes elszaporodott limfocitát. Egy részüket igen, hiszen az autoimmunitás elleni védekezés egy fontos mechanizmusa, hogy az expanzió leállítására is vannak jelpályák, ám a limfociták egy része nem elpusztul, hanem átalakul ún. memóriasejtté. Ez mind a B, mind a T limfocitákkal megtörténik, vannak tehát B és T memóriasejtek. (Kivételt képez a T-independens válasz: ott nem képződnek memóriasejtek.) Míg az expanzió és lezárása néhány napos, hetes folyamat, addig a memóriasejtek hosszú élettartamúak: évekig, sőt, évtizedek a szervezetben maradnak. A jelentőségüket az adja, hogy a következő ugyanolyan kórokozóval való találkozáskor a memóriasejtek is aktiválódnak (a B memóriasejtek plazmasejtté alakulnak és ellenanyagot kezdenek termelni, a T memóriasejtek funkcionális Th vagy Tc sejtté alakulnak) – csakhogy ez sokkal gyorsabb, mint a fent leírt, első találkozáshoz tartozó folyamat! Ezt mutatja a következő ábra, melyen látható, hogy a már egyszer megválaszolt antigénre adott ismételt válasz sokkal gyorsabb és erőteljesebb (miközben egy új antigénre adott válasz változatlan lefutását tekintve).
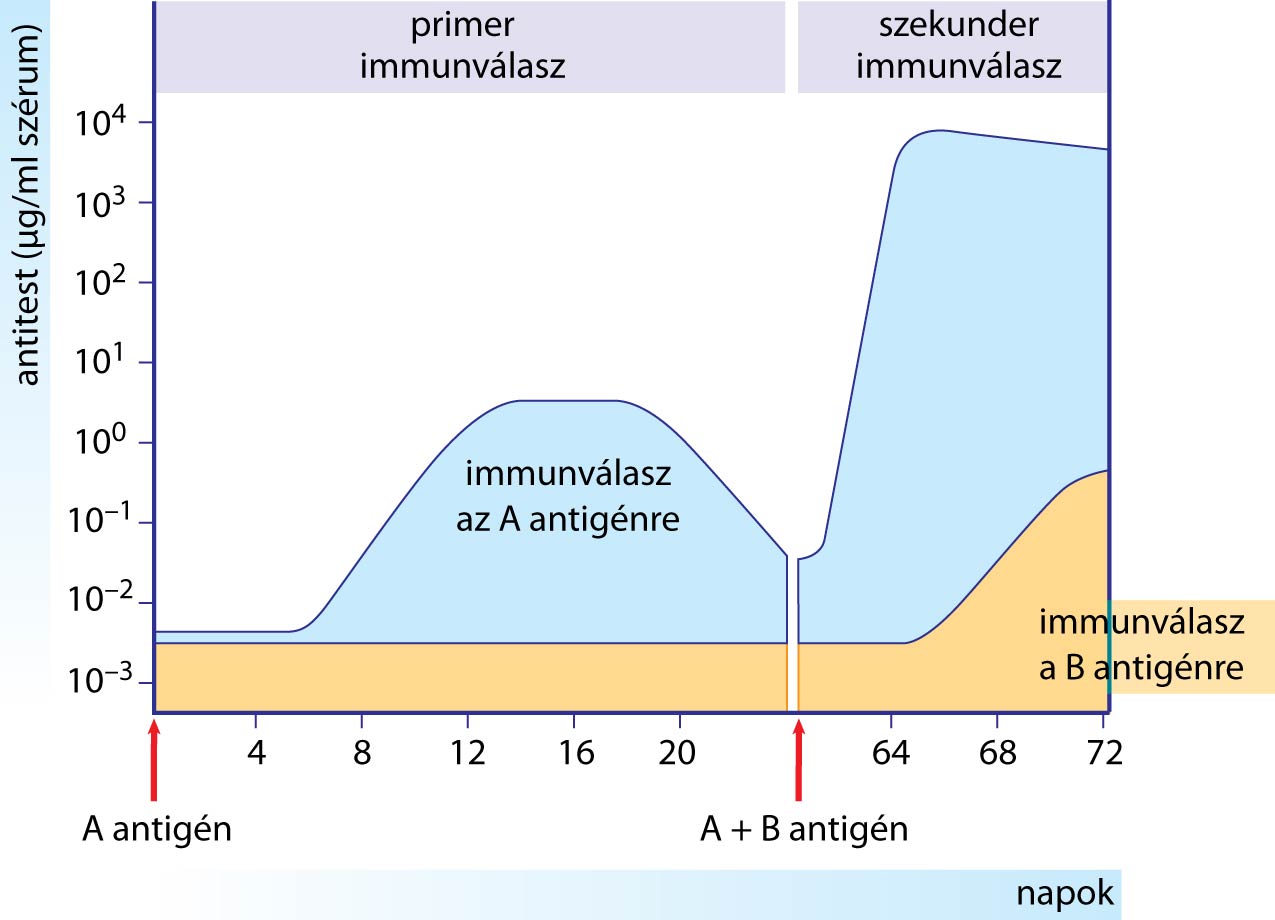
Ez a szerzett immunrendszer tanulása: az antigénnel való második és későbbi találkozáskor már egyre gyorsabb, hatékonyabb választ tud adni. A védőoltások feladata éppen ez: immunológiai memória kialakítása – de az igazi fertőzés kockázatai nélkül.
Bizonyos értelemben az is a limfociták szelekcióját adja, hogy az érett limfocitára szükség lesz-e. Ha ugyanis nem, akkor néhány hét után elpusztul – mindössze ennyi az élettartama. Tehát, ha a limfocita által felismert antigén hetek alatt sem kerül a szervezetbe, akkor a limfocita elveszik – ami logikus is, hiszen ez a tény arra utal, hogy az adott antigén talán nem is olyan fontos. Ha viszont a limfocita antigénnel találkozik, akkor a fenti mechanizmus révén "megőrződik" ez az információ – így végül idővel az immunrendszer egyre jobban hozzáalakul az alany környezetéhez, adaptálódik ahhoz... innen is az adaptív immunitás elnevezés.
Végezetül érdemes pár szót, ismét csak nagyon leegyszerűsítve, ejteni az immunrendszer elemeinek anatómiájáról és fejlődéstanáról. A legtöbb immunrendszerben dolgozó sejt a vérünk fehérvérsejtnek nevezett alakos elemének valamely típusa. Tudni kell, hogy vérünk valamennyi alakos eleme ugyanabból a közös őssejtből alakul ki (hemopoetikus őssejt). Ez két irányba differenciálódik: az ún. myeloid vonalból alakulnak ki a vörösvértestek, a vérlemezkék, és a fehérvérsejtek közül a makrofágok, a dendritikus sejtek, valamint a bazofil, a neutrofil és az eozinofil granulociták, a másik, ún. lymphoid vonalból alakulnak ki az NK sejtek és mindkét típusú limfocita, a T és B sejt egyaránt.
A limfociták nevét az adja, hogy hol történik az érésük. A vérképzés helye születésünk idejére már szinte teljes egészében a vörös csontvelőbe kerül (bár az változik a méhen kívüli élet során is, hogy mely csontok csontvelője dominál), ám a limfociták, bár itt keletkeznek, végleges érésükhöz más helyre vándorolnak. A T limfociták a csecsemőmirigybe (thymus, innen a T), a B limfociták nevét pedig az adta, hogy a madarak bursa Fabricii nevű szervével ekvivalens szervébe, ma már tudjuk, hogy ez nem más mint szintén a csontvelő. Ezek az ún. elsődleges (vagy centrális) nyirokszervek. A T és B limfociták receptorai itt alakulnak ki, itt zajlanak le a centrális toleranciát kialakító szelekciók is.
Ezt követően a limfociták kiáramlanak az érési centrumból a perifériára: átkerülnek másodlagos nyirokszervekbe. A legfontosabb ilyen másodlagos nyirokszerv a lép és a nyirokcsomók, de ugyanígy másodlagos nyirokszervet jelentenek a mandulák, a féregnyúlvány (köznapi nevén a vakbél), ma már tudjuk, hogy ilyen szerepet töltenek be a vékonybél falán lévő kis tüszőcsoportosulások, a Peyer-plakkok és számos egyéb, nyálkahártyán található nyirokszövet-képződmény, melyek összefoglaló nevén MALT-nak szokás nevezni. Rendkívül fontos immunológiai szerepet lát el a bőr is.
Az ezen másodlagos nyirokszervekben található limfociták egyrészt közvetlenül kapcsolatba kerülhetnek a kórokozókkal (épp ez magyarázza, hogy sűrűbben fordulnak elő a tipikus behatolási kapuknál: gyomor-bél traktus, orr, légutak stb., illetve a vérkeringésbe kerültek esetén a lép), másrészt a szervezetünk egy specializált rendszere kifejezetten gondoskodik arról, hogy odaszállítsa az antigéneket – ez a nyirokkeringés; tipikusan a bőrön keresztül bekerülő antigéneknél nyer jelentőséget. A bőrben, illetve az alatta lévő kötőszövetben ugyan rengeteg APC van, ám limfocita nincs, ezért az APC felveszi az antigént, belép a nyirokkeringésbe, és ott utazva jut el a legközelebbi nyirokcsomóba. Itt már várják őt a limfociták és sor kerül a fent leírt folyamatok beindulására. Minden nyirokcsomónak vannak "odavezető" (afferens) nyirokerei, itt lépnek be az APC-k és a limfociták (a perifériára kikerülésük során), valamint "elvezető" (efferens) nyirokerei, itt lépnek ki a feldolgozás utáni, illetve szükségtelenné vált sejtek; ezek nagyobb nyirokcsomókba vagy – végeredményben – valamely vénába torkollnak. Kevesen gondolnák, de felnőttben napi 15-20 liter vér szűrődik ki nyirokká majd jut vissza a vérkeringésbe miután végighaladt a nyirokkeringésen. Ez a mechanizmus teszi lehetővé, hogy az antigénprezentáló sejtek és a nekik megfelelő limfociták kellően nagy valószínűséggel találkozzanak, és a fentiekben leírt immunválasz létrejöhessen, azaz, hogy az immunrendszerünk ilyen módon (is) be tudja tölteni funkcióját.
(Az írás ábráit Prof. Dr. Falus András (Semmelweis Egyetem, Genetikai, Sejt- és Immunbiológia Intézet) és Ferenci Tamás vázlatai alapján Bodor Zoltán (Medicina Könyvkiadó) rajzolta.)